|
|
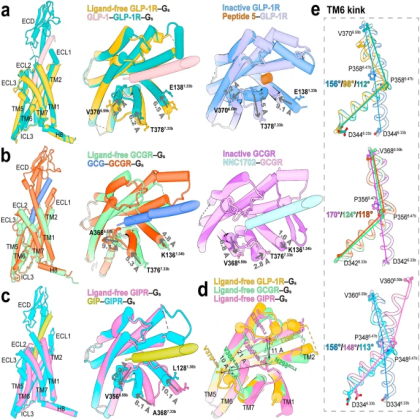
B1类G蛋白偶联受体(GPCR)是许多生理功能(如葡萄糖平衡)的重要调节器,葡萄糖平衡主要由三种肽类激素(即胰高血糖素样肽-1(GLP-1)、胰高血糖素(GCG)和葡萄糖依赖性促胰岛素多肽(GIP))介导。它们会触发一连串的信号传导事件,从而形成活跃的激动剂-受体-G 蛋白复合物。然而,细胞内的信号转导物也能激活受体,而不受细胞外刺激的影响,这表明G蛋白在这一过程中发挥着内在作用。但其激活机制仍旧不太清楚。 近段时间,来自中国上海复旦大学基础医学院药理学系的Zhaotong Cong教授及团队报告了人类GLP-1 受体(GLP-1R)、GCG受体(GCGR)和GIP受体(GIPR)在没有同源配体存在的情况下与Gs蛋白复合物的冷冻电镜结构,旨在为了解这三种重要受体的不同激活机制提供了宝贵的见解。 结果显示,无配体受体成功地促进了TM6胞质半部的大幅外移,并重组了HETY和胞质极性网络,为G蛋白耦合打开了一条胞内缝隙。无配体受体的TMs 1、6和7的细胞外半部在结构上都与多肽结合受体不同,具有受体特异性。无配体和Gs耦合的GLP-1R、GCGR和 GIPR的结构表明,Gs蛋白不仅在没有激动剂作用的情况下 成功打开了细胞内结合腔,而且还重新连接了细胞外正交口袋,使受体稳定在过渡状态,为激动剂结合做好了准备。在没有激动剂结合的情况下,ECL具有构成性柔韧性,因此其构象不同于在活性和非活性状态下观察到的构象。在没有配体的情况下,TMD的细胞内半部分可被Gs蛋白独立调动,进而重新排列细胞外半部分,形 成过渡构象。这种状态下的受体可以同时调动正交口袋和ECL,以促进肽N端进入,从而导致下游信号事件。 总之,该发现将拓宽人们对B1类GPCR激活机制的整体认识,并为开发更好的针对GLP-1R、GCGR和 GIPR的疗法提供启示。 |